Почему при диабете немеют ноги
Онемение ног при сахарном диабете развивается как проявление диабетической полинейропатии — повреждения периферических нервов, которое затрагивает от 50% до 70% пациентов с длительным течением заболевания. Хронически повышенный уровень глюкозы запускает токсическое воздействие на нервные волокна и нарушает микроциркуляцию в сосудах, питающих нервы, что приводит к постепенной потере чувствительности по типу «носков и перчаток». Без своевременного выявления и коррекции это состояние прогрессирует до синдрома диабетической стопы, который в 15% случаев заканчивается ампутацией нижних конечностей. Разбираем механизмы развития нейропатии, методы ранней диагностики и доказанные подходы к лечению, которые позволяют сохранить функцию нервов и предотвратить необратимые осложнения.
Что такое онемение ног при диабете и как оно связано с нейропатией
Онемение ног при сахарном диабете представляет собой клиническое проявление диабетической полинейропатии — прогрессирующего повреждения периферических нервных волокон, которое развивается у 50-70% пациентов с длительным течением заболевания. Термин «полинейропатия» означает одновременное поражение множества нервов в определенной анатомической области, преимущественно нижних конечностей.
Механизм развития онемения связан с дегенерацией аксонов — длинных отростков нейронов, передающих электрические импульсы от центральной нервной системы к тканям. При диабете этот процесс протекает по типу «носков и перчаток»: сначала страдают самые длинные нервные волокна, идущие к стопам, затем патология распространяется в проксимальном направлении. Аналогию можно провести с электрическим кабелем, у которого повреждается изоляция сначала на дальнем конце, постепенно разрушаясь к источнику питания.
Диабетическая нейропатия затрагивает как соматическую нервную систему, отвечающую за чувствительность кожи и движения мышц, так и автономную, регулирующую работу внутренних органов. У 20-40% пациентов с диабетом выявляется поражение автономной нервной системы, что является независимым прогностическим фактором повышенной смертности. Компромисс здесь заключается в том, что онемение может субъективно казаться менее опасным симптомом по сравнению с болью, однако именно потеря чувствительности повышает риск незамеченных травм стопы.
Потеря защитной чувствительности при нейропатии делает пациентов уязвимыми перед механическими повреждениями, которые остаются незамеченными. Даже минимальные травмы кожи стопы, включая проблемы с ногтями, могут привести к серьезным инфекционным осложнениям. При снижении чувствительности требуется регулярный визуальный осмотр стоп и своевременное обращение за помощью, например, при развитии такой патологии как вросший ноготь москва может предложить специализированное лечение с применением современных методов.
Согласно данным клинических исследований, диабетическая автономная нейропатия отчетливо снижает коэффициент выживаемости пациентов и служит важным независимым прогностическим фактором смертности лиц с сахарным диабетом.
Ранняя диагностика нейропатии критична, поскольку необратимое повреждение нервных волокон начинается задолго до появления выраженных симптомов. Исследования показывают, что весь нейрон — от тела клетки до терминальных участков аксона — служит мишенью для патологических процессов при диабете. Это означает, что профилактические меры должны начинаться с момента установления диагноза сахарного диабета, независимо от наличия субъективных жалоб.
Почему при сахарном диабете развивается потеря чувствительности в стопах
Потеря чувствительности в стопах при диабете обусловлена комбинацией метаболических и сосудистых нарушений, которые вызывают структурную деградацию нервных волокон. Хроническая гипергликемия запускает каскад патологических реакций, приводящих к повреждению практически всех отделов периферической нервной системы. Основными драйверами патогенеза служат не только повышенный уровень глюкозы, но и гиперлипидемия, а также нарушение передачи сигналов инсулина.
Анатомически нейроны стоп обладают самыми длинными аксонами в человеческом теле — их протяженность может достигать одного метра от спинного мозга до пальцев ног. Эти нервные волокна особенно уязвимы перед метаболическими нарушениями из-за значительной удаленности от тела нейрона, где происходит синтез необходимых для жизнедеятельности белков и органелл. Дистальные участки аксонов первыми испытывают дефицит энергетических ресурсов и защитных факторов, что объясняет характерное начало симптомов именно со стоп.
| Механизм повреждения | Патофизиологический процесс | Клиническое проявление |
|---|---|---|
| Метаболический | Активация полиолового пути, накопление сорбитола, истощение миоинозитола | Снижение скорости проведения импульса по нервам |
| Окислительный стресс | Избыточное гликирование белков миелина и тубулина | Демиелинизация и дегенерация аксонов |
| Сосудистый | Повреждение эндотелия vasa nervorum, микроваскулярная дисфункция | Ишемия нервной ткани и прогрессирование нейропатии |
Критическую роль играет дисфункция vasa nervorum — микроскопических сосудов, питающих нервные стволы. Окислительный стресс повреждает эндотелиальные клетки этих капилляров, что приводит к снижению кровотока в нервах и развитию локальной ишемии. Компромисс между метаболической и сосудистой теориями патогенеза заключается в том, что оба механизма взаимно усиливают друг друга: гипергликемия повреждает сосуды, а нарушенное кровоснабжение ухудшает метаболизм нейронов.
Дополнительным фактором служит дефицит полиненасыщенных жирных кислот, синтез которых снижается в условиях гипергликемии. Этот дефицит пагубно воздействует на кровоток по vasa nervorum, уменьшает синтез простаноидов и нарушает внутриклеточный кальциевый гомеостаз. Цена этих метаболических нарушений — прогрессирующая утрата функции нервов, которая при отсутствии коррекции углеводного обмена становится необратимой.
Роль повышенного уровня глюкозы в повреждении нервных волокон
Гипергликемия выступает ключевым патогенетическим фактором повреждения нервных волокон, запуская множество взаимосвязанных токсических механизмов. Избыток глюкозы, который не может быть утилизирован через нормальный гликолитический путь с участием гексокиназы, активирует альтернативный полиоловый путь метаболизма. Этот компенсаторный механизм, в норме играющий минорную роль, при диабете становится источником клеточного повреждения.
Ключевой фермент альдозредуктаза преобразует избыточную глюкозу в сорбитол, который затем окисляется сорбитолдегидрогеназой с образованием фруктозы. Внутриклеточное накопление сорбитола вызывает осмотические нарушения: молекулы сорбитола плохо диффундируют через клеточную мембрану, притягивают воду, что приводит к набуханию нейронов и последующей их гибели. Можно провести аналогию с губкой, помещенной в сахарный сироп — она впитывает жидкость до разрушения своей структуры.
Биохимические последствия активации полиолового пути
Активация полиолового шунта приводит к истощению запасов миоинозитола — «вторичного мессенжера», критически важного для функционирования нервных клеток. Дефицит миоинозитола снижает активность Na+/K+-АТФазы — фермента, поддерживающего электрохимический градиент на мембране нейрона. Это вызывает накопление внутриклеточного натрия, структурные изменения нейронов и замедление проведения нервного импульса по миелиновым волокнам.
Вторым критическим механизмом служит неферментативное гликирование белков — химическая модификация структурных компонентов нервного волокна молекулами глюкозы. Гипергликемия многократно ускоряет процессы гликирования миелина (изолирующей оболочки нервов) и тубулина (белка цитоскелета аксонов), причем скорость этих реакций дополнительно возрастает в присутствии фруктозы. Гликированные белки теряют свои функциональные свойства, что нарушает структурную целостность нервных волокон.
- Конечные продукты гликирования (AGEs)
- Необратимые соединения, образующиеся при длительном воздействии глюкозы на белки, которые накапливаются в тканях и вызывают воспалительные реакции и окислительный стресс
- Окислительный стресс
- Избыточная продукция активных форм кислорода при метаболизме глюкозы, повреждающих клеточные мембраны, ДНК и белки нейронов
- Миоинозитол
- Циклический спирт, участвующий в передаче сигналов внутри клетки и регуляции активности ионных насосов в нейронах
Крупные мультицентровые исследования неоднократно подтверждали прямую взаимосвязь между уровнем глюкозы в крови и степенью поражения нервных волокон. Контроль гликемии представляется наиболее эффективным мероприятием, замедляющим прогрессирование нейропатии и отсрочивающим ее дебют. Однако цена компромисса состоит в том, что нормализация углеводного обмена должна быть постоянной и пожизненной — даже эпизоды гипергликемии накапливают необратимые повреждения нервной ткани.
Хроническая гипергликемия вызывает каскад метаболических реакций, который приводит к повреждению практически всех отделов периферической нервной системы. Поэтому контроль гликемии представляется самым эффективным мероприятием для замедления прогрессирования нейропатии.
Влияние нарушения кровоснабжения на развитие симптомов
Нарушение микроциркуляции в vasa nervorum — мелких сосудах, питающих нервные стволы — усугубляет метаболические повреждения и ускоряет развитие клинических симптомов нейропатии. Сосудистая дисфункция при диабете создает состояние хронической ишемии нервной ткани, которая особенно чувствительна к дефициту кислорода и питательных веществ.
Гипергликемия повреждает эндотелий капилляров через несколько механизмов: активацию протеинкиназы C, усиление окислительного стресса и образование конечных продуктов гликирования в стенках сосудов. Эндотелиальная дисфункция приводит к снижению выработки оксида азота — ключевого вазодилататора, что вызывает сужение просвета сосудов и нарушение реологических свойств крови. Аналогично водопроводной системе со ржавыми трубами, где постепенное сужение диаметра снижает поток воды к конечным точкам, микроваскулярные нарушения ограничивают доставку кислорода к дистальным участкам нервов.
Компромисс между метаболической и сосудистой теориями патогенеза заключается в их синергетическом взаимодействии: гипергликемия запускает токсические процессы в нейронах, одновременно повреждая питающие их капилляры, что создает порочный круг прогрессирующей дегенерации. Ишемия нервной ткани нарушает аксональный транспорт — перемещение органелл и белков от тела нейрона к периферическим участкам аксона, что критично для поддержания структуры длинных нервных волокон.
Повреждение эндотелия vasa nervorum и связанная с этим микроваскулярная дисфункция играют существенную роль в патогенезе диабетической полинейропатии, вызывая ишемию нервной ткани и усиливая метаболические нарушения.
Дополнительным фактором служит нарушение синтеза эндогенных вазодилататоров и простаноидов при гипергликемии. Дефицит полиненасыщенных жирных кислот, наблюдаемый у пациентов с диабетом, пагубно воздействует на кровоток по vasa nervorum и уменьшает синтез простациклина — вещества, расширяющего сосуды и предотвращающего тромбообразование. Цена этого нарушения — прогрессирующая гипоксия нервных волокон, которая в сочетании с метаболическими расстройствами приводит к необратимой гибели аксонов.
Роль нарушения аксонального транспорта
При ишемии затрудняется перемещение митохондрий, синтетических ферментов и нейротрансмиттеров от тела нейрона к терминальным участкам аксона. Дистальные отделы нервов длиной до одного метра оказываются отрезанными от источников энергии и структурных белков, что приводит к феномену «dying-back» — обратной дегенерации от периферии к центру. Этот процесс объясняет характерное начало симптомов со стоп и постепенное распространение в проксимальном направлении.
Как проявляется онемение ног на ранних стадиях диабетической нейропатии
На ранних стадиях диабетическая нейропатия манифестирует позитивными сенсорными симптомами — спонтанными патологическими ощущениями, возникающими без внешнего раздражителя, которые предшествуют собственно онемению. Эти проявления отражают раздражение и дисфункцию нервных волокон до их полной гибели.
Первые симптомы обычно появляются симметрично в наиболее удаленных от туловища участках — пальцах ног и подошвенной поверхности стоп. Пациенты описывают ощущения как «ползание мурашек», покалывание иголками, жжение или чувство «хождения по песку». Характерна ночная акцентуация симптомов: дискомфорт усиливается в покое и в постели, когда исчезают отвлекающие дневные стимулы и снижается порог восприятия боли. Можно провести аналогию с радиоприемником, который лучше ловит слабые сигналы в тишине ночи, чем в шумной дневной обстановке.
| Стадия развития | Тип симптомов | Клинические проявления |
|---|---|---|
| Ранняя (0-2 года) | Позитивные сенсорные | Парестезии, покалывание, жжение, гиперестезия |
| Промежуточная (2-5 лет) | Смешанные | Чередование онемения и болевых ощущений, снижение вибрационной чувствительности |
| Поздняя (>5 лет) | Негативные сенсорные | Полная потеря чувствительности, безболевые травмы, язвы стоп |
Критическая особенность ранней нейропатии — диссоциация между субъективными жалобами и объективными находками. Пациент может испытывать интенсивный дискомфорт при сохранной или даже повышенной чувствительности к прикосновениям и температуре при неврологическом обследовании. Эта стадия «раздраженного нерва» постепенно сменяется истинным онемением по мере гибели нервных волокон.
Существенную опасность представляет безболевая нейропатия, которая встречается у 15-25% пациентов с диабетом. При этом варианте минимальные субъективные ощущения сочетаются с выраженным снижением защитной чувствительности, что многократно повышает риск незамеченных травм. Парадоксально, но отсутствие боли при нейропатии служит неблагоприятным прогностическим признаком, поскольку лишает пациента естественного предупреждающего сигнала о повреждении тканей.
У некоторых пациентов диабетическая нейропатия протекает бессимптомно, что создает ложное ощущение благополучия, но при этом снижение защитной чувствительности стопы остается критическим фактором риска развития язвенных дефектов.
Типичные ощущения: покалывание, мурашки и жжение
Парестезии — спонтанные патологические ощущения покалывания, ползания мурашек и жжения — представляют собой результат эктопической генерации нервных импульсов в поврежденных, но еще функционирующих нервных волокнах. Эти симптомы возникают без внешнего раздражителя вследствие нестабильности мембраны аксонов и формирования участков с измененным порогом возбудимости.
Механизм развития парестезий связан с демиелинизацией — разрушением изолирующей оболочки нерва и последующим обнажением аксонального цилиндра. В норме миелин обеспечивает скачкообразное проведение импульса по нерву со скоростью 50-70 м/с, изолируя участки между перехватами Ранвье. При разрушении миелина оголенные участки аксона становятся генераторами спонтанной электрической активности, подобно оголенному электрическому проводу, который искрит и создает короткие замыкания. Мозг интерпретирует эти хаотичные сигналы как покалывание, жжение или другие необычные ощущения.
- Покалывание возникает при высокочастотной импульсации тонких миелинизированных А-дельта волокон, отвечающих за быструю передачу болевых и температурных стимулов
- Жжение связано с активацией немиелинизированных С-волокон, проводящих медленную тупую боль и температурные ощущения со скоростью 0,5-2 м/с
- Ползание мурашек отражает нарушение проприоцептивной чувствительности крупных миелинизированных А-бета волокон, передающих информацию о прикосновении и положении тела
Характерна температурная зависимость симптомов: холод часто провоцирует или усиливает парестезии, поскольку снижает скорость проведения импульса по поврежденным нервам и изменяет активность ионных каналов в мембране аксонов. Пациенты отмечают усиление дискомфорта при охлаждении ног или в холодное время года. Компромисс заключается в том, что согревание стоп может временно облегчить симптомы, однако использование грелок опасно из-за снижения температурной чувствительности — существует риск ожогов, которые останутся незамеченными.
- Дизестезия
- Извращенное восприятие обычных ощущений, когда прикосновение воспринимается как боль или жжение
- Гипералгезия
- Усиленная болевая реакция на слабые болевые стимулы, связанная с повышенной возбудимостью ноцицептивных нейронов
- Аллодиния
- Болевое восприятие неболевых раздражителей, например, ощущение жжения от прикосновения одежды к коже стоп
Прогрессирование симптоматики следует характерной временной динамике: интенсивность парестезий обычно максимальна на ранних стадиях нейропатии и парадоксально уменьшается по мере гибели нервных волокон. Пациенты могут ошибочно интерпретировать это как улучшение, тогда как фактически происходит переход от стадии «раздраженного нерва» к стадии «мертвого нерва» с полной потерей чувствительности. Именно на этапе мнимого облегчения максимально возрастает риск незамеченных травм и развития синдрома диабетической стопы.
Пять основных способов борьбы с онемением ног при диабете включают жесткий контроль уровня сахара в крови, физические упражнения для улучшения кровообращения, отказ от курения, ограничение алкоголя и регулярный осмотр стоп для раннего выявления проблем.
Прогрессирование симптомов от пальцев к коленям
Диабетическая полинейропатия прогрессирует по дистально-проксимальному градиенту, начинаясь с пальцев стоп и постепенно распространяясь вверх в направлении коленей и выше по типу «носков и перчаток». Эта закономерность отражает зависимость степени повреждения от длины нервных волокон — самые протяженные аксоны страдают первыми.
Анатомическая основа такого распространения связана с феноменом «dying-back» — обратной дегенерации нервного волокна от периферии к центру. Дистальные участки аксонов наиболее удалены от тела нейрона, где происходит синтез необходимых белков и органелл, поэтому первыми испытывают дефицит трофических факторов и энергетических ресурсов. Можно провести аналогию с системой центрального отопления в многоэтажном доме: при снижении давления в магистрали верхние этажи (дистальные участки нервов) первыми остаются без тепла, тогда как нижние этажи (проксимальные отделы) продолжают функционировать.
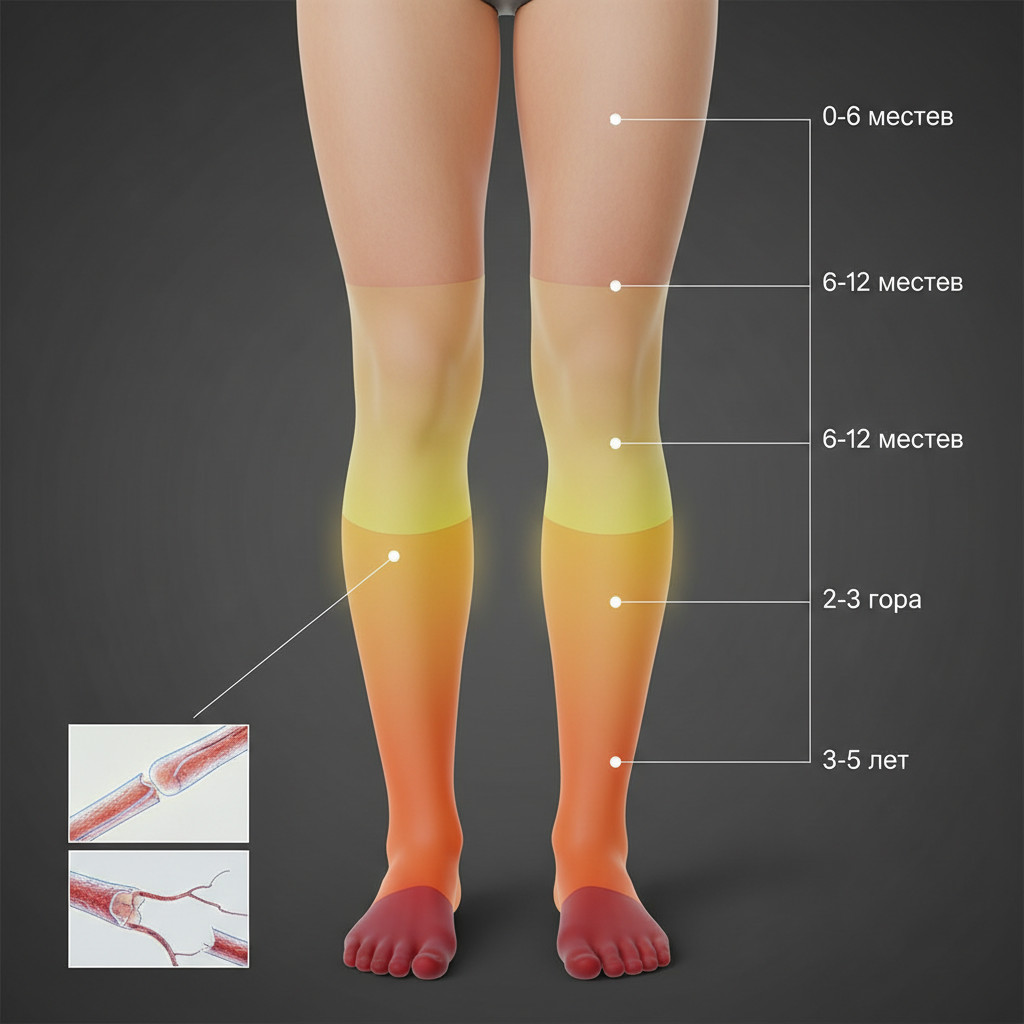
Типичная последовательность распространения симптомов следует четкой хронологии. На первом этапе онемение и парестезии затрагивают подушечки пальцев ног и межпальцевые промежутки. Через 6-12 месяцев зона нарушенной чувствительности расширяется на подошвенную и тыльную поверхность стопы. При дальнейшем прогрессировании граница онемения поднимается на уровень лодыжек, формируя классический паттерн «низких носков». На продвинутых стадиях, обычно через 3-5 лет от начала симптомов, зона анестезии достигает середины голени или коленей, приобретая конфигурацию «высоких сапог».
Характерной особенностью диабетической полинейропатии является симметричное поражение дистальных отделов нижних конечностей по типу «носков и перчаток», что отражает зависимость степени повреждения нервов от их длины.
Критическим пороговым моментом служит распространение онемения выше лодыжек на голень. Этот этап совпадает с появлением двигательных нарушений: слабости мышц стопы, затруднений при подъеме на носки или пятки, изменения походки. Пациенты начинают испытывать трудности при ходьбе по неровной поверхности, поскольку утрата проприоцептивной чувствительности нарушает автоматический контроль положения стопы. Цена такого прогрессирования — многократное увеличение риска падений и переломов, особенно у пожилых пациентов.
Вовлечение верхних конечностей
При длительном течении диабета и недостаточном контроле гликемии нейропатия распространяется на верхние конечности, затрагивая пальцы рук, кисти и предплечья по аналогичному дистально-проксимальному паттерну «перчаток». Этот этап обычно наступает через 5-10 лет после появления симптомов в ногах и указывает на генерализованное поражение периферической нервной системы. Онемение рук существенно ограничивает бытовые навыки и самообслуживание, затрудняя выполнение тонких манипуляций.
Скорость прогрессирования нейропатии индивидуальна и напрямую зависит от качества контроля углеводного обмена. При уровне гликированного гемоглобина HbA1c выше 8% граница онемения поднимается в среднем на 2-3 см в год, тогда как при целевых значениях HbA1c ниже 7% прогрессирование может замедлиться до 0,5-1 см в год или полностью остановиться. Однако существует точка необратимости: после гибели критической массы нервных волокон восстановление чувствительности становится невозможным даже при нормализации глюкозы.
Какие методы диагностики применяются для выявления нейропатии
Диагностика диабетической нейропатии основывается на комбинации клинического неврологического обследования и электрофизиологических методов исследования, которые позволяют объективизировать степень повреждения нервных волокон на доклинической стадии. Раннее выявление нейропатии критично для предотвращения необратимых осложнений.
Клиническая диагностика начинается со структурированного опроса пациента с использованием валидированных опросников. Наиболее распространенными инструментами служат шкала TSS (Total Symptom Score) для оценки выраженности симптомов и опросник DN4 (Douleur Neuropathique 4 Questions) для дифференциации нейропатической боли от других типов болевых синдромов. Эти шкалы количественно оценивают интенсивность жжения, покалывания, онемения и болевых ощущений по градуированной системе от 0 до 10 баллов.
| Метод диагностики | Оцениваемые параметры | Чувствительность выявления |
|---|---|---|
| Монофиламентный тест | Порог тактильной чувствительности, защитная чувствительность | 85-90% для тяжелой нейропатии |
| Градуированный камертон 128 Гц | Вибрационная чувствительность, функция крупных миелиновых волокон | 75-80% для ранней нейропатии |
| Электронейромиография (ЭНМГ) | Скорость проведения импульса, амплитуда потенциалов | 95-98% с количественной оценкой |
| Тестирование тепловой/холодовой чувствительности | Функция тонких немиелиновых С-волокон | 70-75% для малых волокон |
Электрофизиологическая диагностика представляет собой золотой стандарт объективной оценки состояния периферических нервов. Электронейромиография (ЭНМГ) измеряет скорость проведения нервного импульса по двигательным и чувствительным волокнам, а также амплитуду М-ответа — суммарного потенциала действия мышцы при стимуляции нерва. При диабетической нейропатии скорость проведения снижается с нормальных 50-60 м/с до 30-40 м/с и ниже, что отражает демиелинизацию и аксональную дегенерацию.
Компромисс между клиническими и инструментальными методами заключается в их дополняющей роли: клинические тесты просты, доступны для скрининга в амбулаторных условиях и не требуют специального оборудования, однако выявляют нейропатию только на стадии выраженных нарушений. Электрофизиологические исследования обладают высокой чувствительностью и специфичностью, позволяют обнаружить субклинические изменения за 2-3 года до появления симптомов, но требуют дорогостоящего оборудования и специально обученного персонала.
Согласно критериям диагностики, диабетическая полинейропатия устанавливается при наличии признаков поражения периферических нервов у пациентов с сахарным диабетом после исключения других причин нейропатии.
Для выявления нейропатии малых волокон, которая не определяется стандартной ЭНМГ, применяются специализированные методы: количественное сенсорное тестирование (QST) с оценкой порогов восприятия тепла, холода и боли, а также конфокальная микроскопия роговицы для подсчета плотности нервных волокон. Биопсия кожи с подсчетом плотности интраэпидермальных нервных волокон считается наиболее точным методом, однако инвазивность процедуры ограничивает ее применение в рутинной практике.
- Монофиламент Семмеса-Вайнштейна 10 г
- Калиброванное нейлоновое волокно, которое при нажатии создает стандартное давление 10 грамм для оценки порога защитной тактильной чувствительности
- Скорость проведения по нерву (СПН)
- Показатель, отражающий время прохождения электрического импульса по нервному волокну, измеряемый в метрах в секунду
- Амплитуда М-ответа
- Величина суммарного потенциала действия мышцы, отражающая количество сохранных аксонов в нерве
Неврологическое обследование и оценка чувствительности
Неврологическое обследование при подозрении на диабетическую нейропатию включает систематическую оценку различных модальностей чувствительности, сухожильных рефлексов и двигательной функции стоп. Стандартизированный протокол обследования позволяет количественно оценить тяжесть нейропатии и динамику изменений при повторных осмотрах.
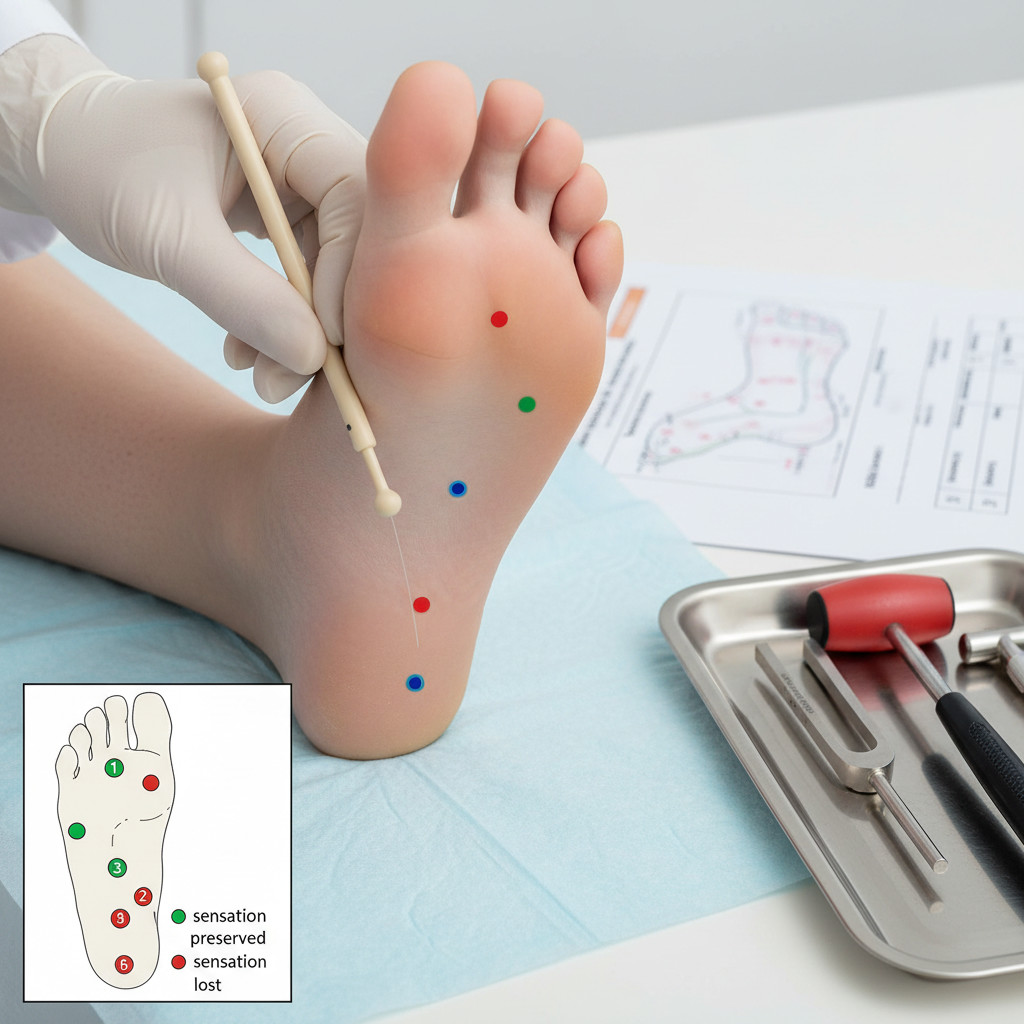
Ключевым компонентом обследования служит тестирование защитной чувствительности с помощью монофиламента Семмеса-Вайнштейна массой 10 грамм. Врач прикладывает монофиламент перпендикулярно к коже подошвенной поверхности стопы в стандартных точках: головки первой, третьей и пятой плюсневых костей, подушечка большого пальца, пятка и тыл стопы между первым и вторым пальцами. Неспособность пациента ощутить прикосновение монофиламента в двух и более точках указывает на утрату защитной чувствительности и высокий риск развития язвенных дефектов.
- Пациент сидит с закрытыми глазами, стопы расположены на подставке
- Врач прикладывает монофиламент к первой тестовой точке до изгибания волокна на 1-2 секунды
- Пациент сообщает, ощущает ли прикосновение и в какой области стопы
- Процедура повторяется для всех 6 стандартных точек на каждой стопе
- Результат документируется в специальной карте обследования стоп
Оценка вибрационной чувствительности проводится градуированным камертоном 128 Гц, установленным на костных выступах: головка первой плюсневой кости, медиальная лодыжка, бугристость большеберцовой кости. Врач фиксирует момент, когда пациент перестает ощущать вибрацию, и оценивает остаточные колебания камертона по 8-балльной шкале. Значение менее 4 баллов (вибрация прекращается более чем через 10 секунд после утраты ощущения пациентом) свидетельствует о нарушении функции крупных миелинизированных волокон.
Исследование температурной чувствительности выполняется с помощью термо-роллеров или тип-терма — устройств, создающих контролируемое тепловое воздействие 40°C и холодовое 25°C. Неспособность различить температурные стимулы указывает на повреждение тонких немиелинизированных С-волокон и А-дельта волокон, что характерно для ранней стадии нейропатии малых волокон. Этот тип нейропатии может длительно не выявляться стандартными тестами и ЭНМГ, создавая ложное впечатление об отсутствии поражения нервов.
Утрата вибрационной чувствительности при тестировании камертоном 128 Гц и неспособность ощутить прикосновение монофиламента 10 г служат надежными предикторами развития язвенных дефектов стоп в течение последующих 3-5 лет.
Оценка сухожильных рефлексов фокусируется на ахилловом рефлексе, который угасает или исчезает у 70-80% пациентов с диабетической полинейропатией. Отсутствие ахиллова рефлекса при сохранном коленном рефлексе подтверждает дистальный характер поражения нервов. Двигательное обследование включает оценку силы мышц-разгибателей и сгибателей пальцев стопы, способности встать на носки и пятки, что позволяет выявить слабость, характерную для продвинутых стадий нейропатии.
Шкалы количественной оценки нейропатии
Для стандартизации результатов обследования применяются валидированные шкалы: NDS (Neuropathy Disability Score) оценивает вибрационную, температурную, болевую чувствительность и рефлексы в баллах от 0 до 10, где значения 3-5 соответствуют легкой, 6-8 — умеренной, 9-10 — тяжелой нейропатии. Шкала MNSI (Michigan Neuropathy Screening Instrument) комбинирует опросник из 15 вопросов с физикальным обследованием, что повышает чувствительность диагностики до 80-85%.
Цена недооценки результатов неврологического обследования — пропуск критического окна для интенсификации терапии. Пациенты с утратой защитной чувствительности по данным монофиламентного теста имеют в 7 раз более высокий риск развития язв стоп и в 15 раз — риск ампутации по сравнению с пациентами с сохранной чувствительностью. Регулярное обследование стоп каждые 6-12 месяцев позволяет своевременно выявлять прогрессирование нейропатии и корректировать терапевтическую стратегию.
Электрофизиологические исследования и их значение
Электронейромиография (ЭНМГ) представляет собой золотой стандарт объективной диагностики диабетической нейропатии, позволяющий количественно оценить функциональное состояние периферических нервов на доклинической стадии заболевания. Метод регистрирует электрическую активность нервов и мышц при их стимуляции, выявляя патологические изменения за 2-3 года до появления клинических симптомов.
Исследование включает две основные методики: стимуляционную электронейрографию, оценивающую проведение импульса по моторным и сенсорным волокнам, и игольчатую электромиографию, анализирующую спонтанную и произвольную активность мышечных волокон. При диабетической нейропатии врач последовательно стимулирует нервы нижних конечностей электрическими импульсами малой силы через накожные электроды, регистрируя параметры распространения возбуждения. Аналогично тестированию кабеля на электрическую проводимость, ЭНМГ позволяет определить, насколько быстро и эффективно нерв передает сигналы.
| Параметр ЭНМГ | Нормальное значение | Изменения при нейропатии |
|---|---|---|
| Скорость проведения по моторным волокнам (СПИм) | 45-60 м/с для нервов голени | Снижение до 30-40 м/с и ниже |
| Скорость проведения по сенсорным волокнам (СПИс) | 50-65 м/с | Снижение на 15-20% и более |
| Амплитуда М-ответа | 5-15 мВ для m. abductor hallucis | Уменьшение более чем на 50% |
| Резидуальная латентность | Менее 2,5 мс | Увеличение до 3-5 мс |
Ключевое преимущество ЭНМГ заключается в способности дифференцировать аксональный и демиелинизирующий типы поражения нервов. При диабете преобладает аксональная дегенерация, характеризующаяся пропорциональным снижением амплитуды потенциалов и скорости проведения, тогда как демиелинизация вызывает преимущественное замедление проведения при относительно сохранной амплитуде. Эта дифференциация критична для прогноза: аксональные повреждения восстанавливаются медленнее и часто необратимы.
Компромисс между доступностью и информативностью ЭНМГ состоит в следующем: исследование обладает чувствительностью 95-98% для выявления нейропатии крупных миелиновых волокон, однако не определяет поражение тонких немиелинизированных С-волокон, которые первыми страдают при диабете. Кроме того, процедура требует специализированного оборудования стоимостью от 2 до 5 миллионов рублей и врача функциональной диагностики с опытом интерпретации результатов, что ограничивает применение метода в амбулаторной практике.
Электронейромиография позволяет объективно зарегистрировать снижение скорости проведения нервного импульса и уменьшение амплитуды потенциалов действия, что служит достоверным подтверждением диагноза диабетической полинейропатии.
- М-ответ
- Суммарный потенциал действия мышцы, возникающий при супрамаксимальной стимуляции двигательного нерва, отражает количество функционирующих аксонов
- Резидуальная латентность
- Разница между измеренной моторной латентностью и расчетной латентностью проведения по нервному стволу, отражает функцию терминальных ветвлений нерва
- F-волна
- Поздний ответ мышцы, возникающий при антидромном возбуждении мотонейронов спинного мозга, используется для оценки проксимальных сегментов нервов
Для диагностики нейропатии малых волокон, не выявляемой стандартной ЭНМГ, применяется количественное сенсорное тестирование (QST) с определением порогов восприятия тепла, холода, вибрации и боли с помощью компьютеризированных устройств. Метод обладает высокой воспроизводимостью результатов, однако зависит от субъективных ответов пациента и требует его активного сотрудничества. Цена отказа от электрофизиологического обследования — невозможность объективного мониторинга эффективности терапии и риск пропуска прогрессирования нейропатии при отсутствии изменений клинических симптомов.
Конфокальная микроскопия роговицы как альтернативный метод
Конфокальная микроскопия роговицы (ККМ) позволяет неинвазивно визуализировать и подсчитать плотность нервных волокон в суб-базальном сплетении роговицы глаза. Снижение плотности волокон менее 12 волокон/мм коррелирует с тяжестью периферической нейропатии. Метод особенно ценен для ранней диагностики нейропатии малых волокон и мониторинга ответа на лечение, однако требует дорогостоящего оборудования и доступен только в специализированных центрах.
Медикаментозное лечение онемения при диабете
Медикаментозная терапия диабетической нейропатии направлена на патогенетическое воздействие — коррекцию метаболических нарушений, вызывающих повреждение нервов, и симптоматическое лечение — устранение болевых ощущений и парестезий. Фундаментальным принципом остается строгий контроль гликемии, поскольку ни один препарат не может компенсировать токсическое влияние хронической гипергликемии.
Патогенетическая терапия включает препараты альфа-липоевой кислоты (тиоктовой кислоты), которые воздействуют на ключевые механизмы повреждения нервов: окислительный стресс, активацию полиолового пути, образование конечных продуктов гликирования. Витамины группы B (B1, B6, B12) в высоких дозах восполняют дефицит нейротропных факторов, необходимых для регенерации миелиновой оболочки и поддержания метаболизма нервной ткани. Альфа-липоевая кислота назначается в начальной дозе 600 мг внутривенно капельно в течение 14-21 дня с последующим переходом на пероральный прием 600 мг в сутки длительностью не менее 3-6 месяцев.
Симптоматическое лечение болевой формы нейропатии базируется на применении препаратов нескольких фармакологических групп. Антиконвульсанты габапентин (900-3600 мг/сут) и прегабалин (150-600 мг/сут) блокируют кальциевые каналы в пресинаптических нейронах, снижая высвобождение возбуждающих нейротрансмиттеров и уменьшая патологическую нейрональную возбудимость. Эффективность этих препаратов составляет 50-60%, что означает уменьшение интенсивности боли на 50% и более у половины пациентов. Антидепрессанты дулоксетин (60-120 мг/сут) усиливают нисходящие тормозные влияния в центральной нервной системе, повышая концентрацию серотонина и норадреналина в синаптической щели.
| Группа препаратов | Механизм действия | Эффективность / Ограничения |
|---|---|---|
| Альфа-липоевая кислота | Антиоксидант, снижает окислительный стресс | Улучшение на 30-50% / требует длительного курса 3-6 месяцев |
| Витамины группы B | Восстановление миелина, нейротрофическая поддержка | Вспомогательный эффект / не заменяет патогенетическую терапию |
| Габапентиноиды (прегабалин) | Блокада α2δ-субъединицы кальциевых каналов | Эффективность 50-60% / седация, головокружение у 30% |
| Дулоксетин | Ингибитор обратного захвата серотонина и норадреналина | Эффективность 45-55% / тошнота в начале лечения |
Компромисс медикаментозной терапии заключается в балансе между эффективностью и переносимостью препаратов. Габапентиноиды эффективно купируют нейропатическую боль, однако вызывают седацию и головокружение у 20-30% пациентов, что требует постепенного титрования дозы начиная с минимальных количеств. Дулоксетин противопоказан при клиренсе креатинина менее 30 мл/мин, что ограничивает его применение у пациентов с диабетической нефропатией. Цена неадекватного обезболивания — формирование хронического болевого синдрома с центральной сенситизацией, который становится резистентным к терапии.
Согласно клиническим рекомендациям, препаратами первой линии для лечения болевой диабетической нейропатии служат прегабалин, габапентин и дулоксетин, демонстрирующие достоверное снижение интенсивности боли в крупных рандомизированных исследованиях.
Местная терапия капсаицином 8% в виде пластыря или крема обеспечивает обезболивающий эффект через истощение субстанции Р в ноцицептивных нервных окончаниях. Преимущество метода — отсутствие системных побочных эффектов, однако при нанесении возникает интенсивное жжение, которое плохо переносится пациентами. Опиоидные анальгетики рассматриваются только как препараты резерва при неэффективности других средств из-за риска развития зависимости и толерантности при длительном применении.
Комбинированная терапия и принцип ступенчатого подхода
При недостаточной эффективности монотерапии применяется комбинация препаратов разных групп: антиконвульсант + антидепрессант или антиконвульсант + альфа-липоевая кислота. Комбинированное лечение позволяет воздействовать на различные звенья патогенеза и повышает частоту ответа до 70-75%. Ступенчатый подход предполагает начало с одного препарата первой линии в минимальной дозе с постепенным титрованием до эффективной или максимально переносимой дозы перед добавлением второго препарата.
Альфа-липоевая кислота и витамины группы B в терапии
Альфа-липоевая кислота (тиоктовая кислота) представляет собой естественный коэнзим митохондриальных ферментных комплексов, обладающий мощными антиоксидантными свойствами и способностью воздействовать на ключевые патогенетические механизмы диабетической нейропатии. Препарат нейтрализует активные формы кислорода, уменьшает активацию полиолового пути, снижает образование конечных продуктов гликирования и улучшает эндоневральный кровоток.
Механизм действия альфа-липоевой кислоты реализуется через несколько путей. Препарат восстанавливает внутриклеточные антиоксиданты — глутатион и витамины С и Е, создавая каскадный защитный эффект. Улучшение микроциркуляции в vasa nervorum происходит за счет увеличения синтеза оксида азота эндотелием и снижения эндотелиальной дисфункции. Клинические исследования ALADIN, SYDNEY, NATHAN демонстрируют снижение выраженности позитивных симптомов (жжение, покалывание, боль) на 30-50% при курсовом применении 600 мг альфа-липоевой кислоты в течение 3-5 недель.
Стандартная схема лечения включает начальный курс внутривенных инфузий 600 мг альфа-липоевой кислоты в 200 мл физиологического раствора медленно капельно в течение 30 минут ежедневно на протяжении 14-21 дня. Раствор готовится непосредственно перед введением и защищается от света светонепроницаемой оболочкой, поскольку препарат фоточувствителен. После завершения инфузионного курса переходят на пероральный прием 600 мг за 30 минут до завтрака натощак длительностью 2-3 месяца с возможным повторением курсов 2-3 раза в год.
Альфа-липоевая кислота демонстрирует способность уменьшать окислительный стресс и улучшать эндоневральный кровоток, что приводит к достоверному снижению выраженности симптомов диабетической нейропатии при курсовом лечении.
Витамины группы B — тиамин (B1), пиридоксин (B6) и цианокобаламин (B12) — играют критическую роль в метаболизме нервной ткани и применяются в высоких фармакологических дозах для лечения нейропатии. Тиамин участвует в углеводном обмене и синтезе миелина, его дефицит при диабете связан с усиленным выведением через почки при глюкозурии. Пиридоксин служит кофактором ферментов синтеза нейротрансмиттеров серотонина и ГАМК. Цианокобаламин необходим для регенерации поврежденных нервных волокон и восстановления миелиновой оболочки.
- Липофильные формы тиамина (бенфотиамин) в дозе 300-600 мг/сут демонстрируют лучшую биодоступность и проникновение в нервную ткань по сравнению с водорастворимыми формами
- Пиридоксин применяется в дозе 100-200 мг/сут, однако длительный прием доз выше 200 мг может парадоксально вызвать сенсорную нейропатию
- Цианокобаламин назначается внутримышечно по 500-1000 мкг ежедневно в течение 10 дней, затем 1-2 раза в неделю курсом 2-3 месяца
Компромисс применения витаминов группы B заключается в том, что они эффективны преимущественно при документированном дефиците этих микронутриентов, тогда как у пациентов с нормальным уровнем витаминов дополнительное назначение дает ограниченный эффект. Комбинированные препараты, содержащие B1+B6+B12, удобны для применения, однако фиксированные дозировки не позволяют индивидуализировать лечение при изолированном дефиците отдельных витаминов. Цена монотерапии витаминами без патогенетических средств — недостаточная эффективность при выраженной нейропатии, требующая комбинированного подхода.
- Бенфотиамин
- Липофильный аналог тиамина с улучшенной биодоступностью, блокирует активацию полиолового пути и снижает образование конечных продуктов гликирования
- Метилкобаламин
- Активная коферментная форма витамина B12, непосредственно участвующая в синтезе миелина и восстановлении поврежденных аксонов
Комбинация альфа-липоевой кислоты с витаминами группы B обеспечивает синергетический эффект, воздействуя на различные звенья патогенеза: антиоксидантную защиту, энергетический метаболизм, регенерацию нервных волокон. Такой комплексный подход рекомендуется у пациентов с умеренной и тяжелой нейропатией в сочетании с оптимизацией гликемического контроля. Продолжительность терапии должна составлять не менее 3 месяцев для достижения клинически значимого улучшения, поскольку регенерация нервных волокон — медленный процесс, требующий длительной метаболической поддержки.
Как правильно ухаживать за ногами при диабетической нейропатии
Правильный уход за стопами при диабетической нейропатии включает ежедневный осмотр, соблюдение гигиены, использование специализированной обуви и профилактику травматизации кожи. Утрата защитной чувствительности превращает рутинные микротравмы в потенциальные источники инфекционных осложнений, требующих системного подхода к профилактике.
Ежедневный визуальный осмотр стоп должен проводиться при хорошем освещении с использованием зеркала для осмотра подошвенной поверхности и межпальцевых промежутков. Пациент выявляет покраснения, потертости, мозоли, трещины, вросшие ногти или изменения цвета кожи, которые могут остаться незамеченными из-за отсутствия болевых ощущений. При наличии снижения зрения или затруднений с самостоятельным осмотром необходимо привлечение родственников или использование увеличительного зеркала на длинной ручке. Аналогично регулярной проверке давления в шинах автомобиля, ежедневный осмотр стоп предотвращает развитие серьезных проблем из незначительных повреждений.
- Мытье стоп ежедневно теплой (не горячей!) водой температурой 35-37°C с нейтральным мылом, проверка температуры локтем или термометром
- Тщательное высушивание кожи промакивающими движениями, особенно между пальцами, где влажность способствует грибковой инфекции
- Нанесение увлажняющего крема на тыльную и боковые поверхности стопы, избегая межпальцевых промежутков
- Обработка ногтей прямым срезом без закругления углов пилкой, а не ножницами, для предотвращения врастания
- Ношение бесшовных носков из натуральных тканей с ежедневной сменой
Выбор обуви при нейропатии требует соблюдения специфических критериев. Ортопедическая обувь с широким носком, мягкой внутренней поверхностью без грубых швов, жестким задником и амортизирующей подошвой распределяет нагрузку равномерно и предотвращает формирование зон избыточного давления. Обувь примеряется во второй половине дня, когда стопы максимально отечны, с запасом 1-1,5 см от кончика большого пальца до края ботинка. Новую обувь разнашивают постепенно, начиная с 30-60 минут в день, с обязательным осмотром стоп после каждого ношения.
Регулярный осмотр стоп, соблюдение правил гигиены, использование правильной обуви и своевременное обращение к специалисту при выявлении минимальных повреждений снижают риск развития язвенных дефектов на 60-70%.
Категорически запрещено использование химических средств для удаления мозолей, хождение босиком даже дома, применение грелок и горячих ванн из-за риска ожогов, самостоятельное удаление мозолей острыми предметами. Обработку гиперкератозов и проблемных ногтей должен проводить медицинский специалист-подолог с использованием стерильных инструментов. Компромисс между самостоятельным уходом и профессиональной помощью заключается в том, что рутинные процедуры (мытье, увлажнение) выполняются пациентом, тогда как любые манипуляции с нарушением целостности кожи требуют обращения к специалисту.
Особенности ухода при деформациях стоп
При наличии деформаций стоп (hallux valgus, молоткообразные пальцы, выступающие головки плюсневых костей) требуется изготовление индивидуальных ортопедических стелек с разгрузкой зон избыточного давления. Использование силиконовых межпальцевых разделителей предотвращает формирование потертостей между пальцами. Пациентам с выраженными деформациями показана консультация ортопеда для решения вопроса о хирургической коррекции до развития осложнений.
Цена несоблюдения правил ухода за стопами — развитие язвенных дефектов в 15-25% случаев в течение года у пациентов с утратой защитной чувствительности. Даже минимальная потертость от неудобной обуви или необработанный вросший ноготь могут трансформироваться в глубокую инфицированную язву, требующую длительного лечения и госпитализации. Систематический уход, образование пациента и регулярное наблюдение мультидисциплинарной команды (эндокринолог, подолог, ортопед) формируют эффективную стратегию предотвращения синдрома диабетической стопы.
Какие осложнения возникают при отсутствии лечения онемения
Прогрессирование нелеченой диабетической нейропатии приводит к развитию синдрома диабетической стопы, который включает язвенные дефекты, инфекционные осложнения, остеоартропатию Шарко и ампутации нижних конечностей. По данным эпидемиологических исследований, 15% пациентов с сахарным диабетом в течение жизни сталкиваются с язвами стоп, из которых 15-24% случаев завершаются ампутацией.
Нейропатические язвы формируются в зонах избыточного давления на подошвенной поверхности стопы — под головками плюсневых костей, на пятке, на вершинах молоткообразных пальцев. Утрата болевой чувствительности приводит к тому, что пациент продолжает нагружать поврежденную область, углубляя дефект до подкожной клетчатки, сухожилий и костей. Патологический процесс можно сравнить с протиранием дыры в ковре от постоянного хождения по одному месту — без боли как сигнала опасности человек не меняет траекторию движения. Присоединение инфекции превращает чистую язву в флегмону или остеомиелит, требующие госпитализации и внутривенной антибиотикотерапии.
Диабетическая остеоартропатия Шарко представляет собой прогрессирующую деструкцию костно-суставного аппарата стопы на фоне нейропатии, встречается у 0,8-7,5% пациентов с диабетом. Патология развивается через неощущаемые повторяющиеся микротравмы костей и связок при продолжающейся нагрузке, что приводит к фрагментации костей, вывихам суставов и коллапсу продольного свода стопы. Острая стадия манифестирует отеком, гиперемией и локальным повышением температуры стопы, которые ошибочно принимаются за инфекцию. Без своевременной разгрузки и иммобилизации формируются необратимые деформации типа «стопы-качалки», создающие новые зоны патологического давления.
| Осложнение | Частота развития | Последствия |
|---|---|---|
| Нейропатические язвы | 15% пациентов с диабетом за жизнь | Хроническое течение, инфекция, остеомиелит |
| Остеоартропатия Шарко | 0,8-7,5% пациентов с нейропатией | Необратимые деформации стопы, инвалидизация |
| Ампутации нижних конечностей | 15-24% пациентов с язвами стоп | Утрата конечности, 50% смертность в течение 5 лет |
| Падения и переломы | 2-3 раза чаще при нейропатии | Длительная иммобилизация, декомпенсация диабета |
Автономная нейропатия вызывает дисфункцию потовых желез с развитием ангидроза — сухости кожи стоп, которая приводит к формированию глубоких трещин, служащих входными воротами инфекции. Нарушение симпатической иннервации артериовенозных шунтов увеличивает кровоток через анастомозы в обход капиллярного русла, создавая парадоксальную ситуацию теплой розовой стопы с хорошей пульсацией на артериях при дефиците питания тканей. Этот феномен маскирует тяжесть состояния и затрудняет раннюю диагностику ишемии.
Прогноз после ампутации нижней конечности у пациентов с диабетом крайне неблагоприятен: пятилетняя выживаемость составляет лишь 50-60%, что сопоставимо с выживаемостью при многих онкологических заболеваниях.
Нарушение проприоцептивной чувствительности при нейропатии повышает риск падений и переломов в 2-3 раза по сравнению с пациентами без нейропатии. Утрата информации о положении стопы в пространстве нарушает автоматическую коррекцию походки при движении по неровной поверхности или в темноте. Переломы костей стопы на фоне остеопении, характерной для диабета, могут оставаться незамеченными из-за отсутствия боли, приводя к неправильному сращению и деформациям.
- Малые ампутации
- Удаление пальцев стопы или части стопы в пределах предплюсны, выполняются в 60-70% случаев хирургического лечения диабетической стопы
- Высокие ампутации
- Ампутация на уровне голени или бедра при обширной гангрене или критической ишемии, составляют 30-40% всех ампутаций при диабете
- Флегмона стопы
- Гнойное воспаление подкожной клетчатки с распространением по фасциальным пространствам, требующее экстренного хирургического вмешательства
Цена игнорирования ранних симптомов нейропатии — прогрессирование от онемения до ампутации занимает в среднем 5-7 лет при отсутствии адекватного контроля глюкозы и профилактических мероприятий. Своевременное начало патогенетической терапии, образование пациента в школе диабета, регулярный осмотр стоп и коррекция факторов риска способны предотвратить или отсрочить развитие катастрофических осложнений у 60-85% пациентов.
Профилактика диабетической полинейропатии через контроль глюкозы
Строгий гликемический контроль с поддержанием уровня гликированного гемоглобина HbA1c ниже 7% служит наиболее эффективным методом первичной профилактики диабетической нейропатии и замедления ее прогрессирования. Крупные проспективные исследования DCCT (Diabetes Control and Complications Trial) и UKPDS (United Kingdom Prospective Diabetes Study) убедительно доказали прямую зависимость между качеством контроля углеводного обмена и риском развития нейропатии.
В исследовании DCCT интенсивный контроль глюкозы с достижением HbA1c 7,2% по сравнению со стандартным лечением (HbA1c 9,1%) снизил риск развития клинически значимой нейропатии на 60% у пациентов с сахарным диабетом 1 типа в течение 6,5 лет наблюдения. При диабете 2 типа в исследовании UKPDS снижение HbA1c на каждый 1% ассоциировалось с уменьшением риска микрососудистых осложнений, включая нейропатию, на 37%. Эти данные количественно подтверждают концепцию глюкозотоксичности как основного драйвера повреждения нервов.
Целевые значения гликемического контроля требуют индивидуализации с учетом возраста, длительности диабета, наличия сопутствующих заболеваний и риска гипогликемий. Для большинства взрослых пациентов рекомендуется HbA1c менее 7%, глюкоза плазмы натощак 4,4-7,2 ммоль/л, постпрандиальная гликемия менее 10 ммоль/л. У пожилых пациентов с высоким риском гипогликемий целевой HbA1c может быть менее жестким (7,5-8%), поскольку тяжелые гипогликемии повреждают нервную систему и нивелируют пользу от снижения глюкозы. Компромисс заключается в балансе между профилактикой осложнений и безопасностью терапии.
Хроническая гипергликемия вызывает каскад метаболических реакций, приводящих к повреждению периферических нервов. Контроль гликемии представляется самым эффективным мероприятием для замедления прогрессирования нейропатии и отсрочивания ее дебюта.
Достижение и поддержание целевых значений глюкозы требует комплексного подхода, включающего модификацию образа жизни, рациональную фармакотерапию и самоконтроль. Структурированное обучение пациентов в школе диабета повышает приверженность лечению и улучшает гликемический контроль в среднем на 0,5-1% HbA1c. Регулярная физическая активность умеренной интенсивности (150 минут в неделю) улучшает чувствительность тканей к инсулину, способствует утилизации глюкозы мышцами и снижает уровень гликемии на 10-20%.
- Самоконтроль гликемии с помощью глюкометра или системы непрерывного мониторинга глюкозы (CGM) для оценки вариабельности и коррекции терапии
- Соблюдение низкоуглеводной диеты с ограничением простых сахаров и контролем гликемического индекса продуктов
- Своевременная интенсификация сахароснижающей терапии при отсутствии достижения целевого HbA1c в течение 3 месяцев
- Регулярный контроль HbA1c каждые 3 месяца для объективной оценки качества компенсации углеводного обмена
- Коррекция других факторов риска: артериальной гипертензии (целевое АД менее 140/90 мм рт.ст.), дислипидемии, курения
Цена недостаточного гликемического контроля — необратимое прогрессирование нейропатии даже при последующей нормализации глюкозы. Феномен «метаболической памяти» означает, что длительные периоды гипергликемии в анамнезе продолжают влиять на риск осложнений спустя годы после улучшения контроля. Раннее достижение компенсации углеводного обмена с момента установления диагноза диабета обеспечивает максимальную протекцию нервной системы и снижает пожизненный риск инвалидизирующих осложнений.
Роль вариабельности гликемии в развитии нейропатии
Современные исследования показывают, что не только среднее значение глюкозы (отражаемое HbA1c), но и вариабельность гликемии — колебания уровня глюкозы в течение суток — независимо ассоциируется с риском нейропатии. Частые эпизоды постпрандиальной гипергликемии и ночные гипогликемии создают дополнительный окислительный стресс. Использование систем непрерывного мониторинга глюкозы (CGM) позволяет выявить и минимизировать эти колебания, что может обеспечить дополнительную нейропротекцию при одинаковом HbA1c.
Профилактика вторичного прогрессирования нейропатии у пациентов с уже установленным диагнозом требует еще более строгого контроля гликемии в сочетании с патогенетической терапией альфа-липоевой кислотой и витаминами группы B. Мультифакторный подход, включающий контроль глюкозы, артериального давления, липидов, отказ от курения и алкоголя, снижает риск прогрессирования нейропатии на 50-60% и улучшает долгосрочный прогноз. Систематический скрининг с ежегодным неврологическим обследованием всех пациентов с диабетом позволяет выявить нейропатию на ранней стадии и своевременно интенсифицировать терапию.
Диабетическая нейропатия развивается у 50-70% пациентов с длительным течением диабета через повреждение периферических нервов хронической гипергликемией, окислительным стрессом и нарушением микроциркуляции, прогрессируя от онемения пальцев до синдрома диабетической стопы с риском ампутации в 15-24% случаев при отсутствии лечения. Монотерапия строгим гликемическим контролем (HbA1c менее 7%) снижает риск нейропатии на 60%, однако требует 6-12 месяцев для проявления эффекта и не всегда доступна пациентам с множественными сопутствующими заболеваниями. Патогенетическое лечение альфа-липоевой кислотой 600 мг курсом 3 месяца в сочетании с витаминами группы B обеспечивает уменьшение симптомов на 30-50% за 3-5 недель, но эффективность ограничена при запущенных стадиях с необратимой гибелью нервных волокон. Комплексный подход, объединяющий оптимизацию углеводного обмена, медикаментозную нейропротекцию и профессиональный уход за стопами, демонстрирует снижение риска язвенных дефектов на 60-70% и предотвращает прогрессирование осложнений у большинства пациентов при условии регулярного наблюдения мультидисциплинарной команды специалистов.
Запишитесь на консультацию эндокринолога и подолога для комплексной оценки состояния нервной системы и разработки индивидуальной программы профилактики осложнений. Имеются противопоказания. Необходима консультация специалиста.
Об авторе: Налетова Юлия Сергеевна — специалист-подолог с профессиональной квалификацией в области диагностики и лечения заболеваний стоп. Занимается решением широкого спектра подологических проблем, включая обработку вросших ногтей, грибковые поражения, мозоли, натоптыши и трещины стоп. Применяет современное оборудование и методики для эффективного лечения и профилактики заболеваний.